TRYOUT (TO) KIMIA KELAS XI
SMA SANTA MARIA SURABAYA
TAHUN AJARAN 2018/2019
1. Perhatikan data hasil uji daya hantar listrik terhadap beberapa larutan berikut!
Berdasarkan data tersebut, pasangan larutan
yang memiliki derajat ionisasi = 0, ditunjukkan
pada nomor ….
A. (1) dan (2) D. (3) dan (5)
B. (1) dan (3) E. (4) dan (5)
C. (2) dan (4)
2. Proses pemisahan senyawa dalam suatu campuran melalui distilasi sederhana dimungkinkan karena adanya perbedaan ….
A. titik didih B. warna Kristal C. massa jenis D. keisotopan E. kelarutan
3. Perhatikan gambar kurva titrasi dan tabel data beberapa indikator berikut!

| Indikator | Trayek pH |
| PP BTB MM | 9,1 – 10,0 6,0 – 7,6 4,4 – 6,3 |
Berdasarkan kedua informasi tersebut, dapat diprediksi bahwa zat yang dititrasi oleh penitrasi dan indikator yang digunakan adalah ….
- HCl oleh NaOH, MM D. NH4OH oleh HCl, BTB
- HCl oleh NaOH, PP E. NH4OH oleh HCl, PP
- CH3COOH oleh NaOH, MM
4. Sebanyak 10 mL larutan sampel Ca(OH)2 dititrasi dengan larutan HCl 0,4 M dan diperoleh data sebagai berikut.
| No. | Volume Larutan | |
| Ca(OH)2 x M | HCl 0,4 M | |
| (1) (2) (3) | 10 mL 10 mL 10 mL | 15,0 mL 15,2 mL 14,8 mL |
Jika massa jenis larutan Ca(OH)2 = 1,02 g/cm3 dan Mr Ca(OH)2 = 74 maka kadar Ca(OH)2 dalam sampel tersebut adalah ….
- 1,09% D. 4,40%
- 2,18% E. 8,88%
- 3,84%
5. Di dalam tubuh terdapat larutan penyangga yang menjaga pH darah relatif tetap, yaitu 7,40 – 7,45. Komponen larutan penyangga dalam darah terdiri atas asam karbonat dan basa konjugasinya, ion bikarbonat dengan perbandingan 1 : 20, yang merupakan hasil dari metabolisme pernafasan.
CO2(g) ⇋ CO2(aq)
CO2(aq) + H2O(l) ⇋ H2CO3(aq)
H2CO3(aq) + H2O(l) ⇋ H3O+(aq) + HCO3–(aq)
Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis. Kondisi ini terjadi karena kadar oksigen yang rendah di gunung membuat para pendaki bernafas lebih cepat sehingga gas karbon dioksida yang dilepas terlalu banyak, akibatnya pH darah naik hingga mencapai 7,7 – 7,8.
Pemberian penyangga bikarbonat dalam kondisi ini menyebabkan ….
- Kesetimbangan bergeser ke kiri sehingga pH darah turun
- Kesetimbangan bergeser ke kanan sehingga pH darah turun
- Kesetimbangan tidak bergeser sehingga pH darah tetap
- Kesetimbangan bergeser ke kiri sehingga pH darah naik
- Kesetimbangan bergeser ke kanan sehingga pH darah naik
6. Perhatikan kurva titrasi asam lemah dengan basa kuat berikut!
Berikut data titrasi CH3COOH 0,04 M dengan Ca(OH)2 0,02 pada volume tertentu.
| Percobaan | Volume CH3COOH (mL) | Volume Ca(OH)2 (mL) |
| (1) (2) (3) | 20 20 20 | 10 20 30 |
Percobaan yang menunjukkan campuran bersifat penyangga serta daerah kurva yang sesuai berturut-turut adalah ….
A. (1) dan K – L D. (3) dan N – O
B. (1) dan L – M E. (1) dan K – M
C. (2) dan M – N
7. Sebanyak 100 mL larutan CaCl2 0,05 M dicampurkan dengan 100 mL suatu basa kuat bervalensi 1 pada berbagai pH seperti berikut.
Larutan I : pH = 13
Larutan II : pH = 12
Larutan III : pH = 11
Endapan akan dihasilkan jika larutan CaCl2 dicampurkan dengan larutan ….
(Ksp Ca(OH)2 = 5,5 x 10–6)
A. larutan I karena harga Qc > Ksp D. larutan II karena harga Qc < Ksp
B. larutan I karena harga Qc < Ksp E. larutan III karena harga Qc > Ksp
C. larutan II karena harga Qc > Ksp
8. Persamaan reaksi kesetimbangan suatu larutan garam:
LX + H2O ⇋ LOH + HX
Hasil uji indikatornya sebagai berikut.
| Indikator | Trayek pH | Perubahan Warna | Hasil |
| MM MO BTB PP | 3,0 – 4,4 4,2 – 6,2 6,0 – 7,8 8,3 – 10,0 | Merah – kuning Merah – kuning Kuning – biru Tak berwarna – merah | Merah Merah Kuning Tak berwarna |
Garam berikut yang memiliki sifat yang sama dengan data di atas adalah ….
- CaSO4 D. Ba(NO3)2
- BaSO4 E. NaCH3COO
- NH4Cl
9. Ketika kayu dibakar akan dihasilkan sejumlah kalor. Kalor yang dihasilkan dari pembakaran kayu mengakibatkan keadaan di sekitar menjadi panas. Namun, ketika api sudah padam keadaan menjadi normal kembali.
Berdasarkan wacana tersebut, dapat disimpulkan bahwa peristiwa tersebut merupakan bersifat ….
- Eksoterm, energi berpindah dari lingkungan ke sistem.
- Eksoterm, energi berpindah dari sistem ke lingkungan.
- Eksoterm, perubahan entalpi positif.
- Endoterm, perubahan entalpi negatif.
- Endoterm, energi berpindah dari lingkungan ke sistem.
10. Diketahui energi ikatan rata-rata:
H – H : 435 kJ/mol
H – O : 464 kJ/mol
O = O : 498 kJ/mol
Kalor yang diperlukan untuk menguraikan 1,8 g H2O(g) (Ar H = 1; O = 16) adalah ….
A. 242 kJ D. 46,5 kJ
B. 50,0 kJ E. 24,4 kJ
C. 46,9 kJ
11. Diketahui harga entalpi pembentukan standar senyawa sebagai berikut.
ΔH°f CO2(g) = –394 kJ/mol
ΔH°f H2O(l) = –286 kJ/mol
ΔH°f C2H4(g) = +52 kJ/mol
Senyawa etena dibakar oleh oksigen sesuai reaksi:
C2H4(g) + 3O2(g) à 2CO2(g) + 2H2O(l)
Berdasarkan data tersebut, harga perubahan entalpi pembakaran standar etena adalah ….
A. –1412 kJ/mol D. +1308 kJ/mol
B. –1038 kJ/mol E. +1412 kJ/mol
C. +706 kJ/mol
12. Seorang siswa melakukan percobaan faktor-faktor yang memengaruhi laju reaksi dengan mereaksikan 25 mL larutan HCl dan 2 g pualam (CaCO3) sebagai berikut.
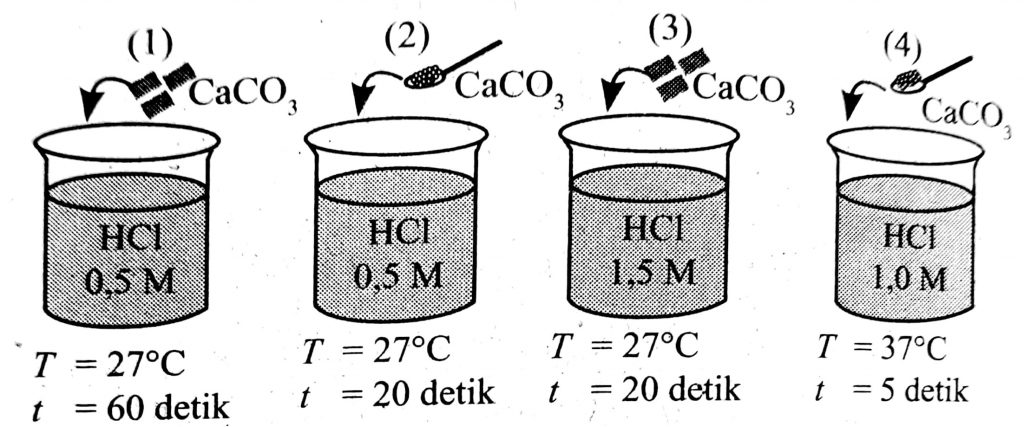
Kondisi yang diharapkan adalah sebagai berikut.
- variabel bebas: konsentrasi HCl
- variabel tetap: luas permukaan CaCO3 dan suhu
- variabel terikat: waktu dan laju reaksi.
Pasangan gambar yang menunjukkan kondisi tersebut adalah ….
A. (1) dan (2) D. (2) dan (4)
B. (1) dan (3) E. (3) dan (4)
C. (2) dan (3)
13. Persamaan laju untuk reaksi:
2N2O4(g) + O2(g) à 2N2O5(g)
Disajikan dalam tabel berikut.
| Percobaan | [N2O4] (M) | [O2] (M) | Laju reaksi (M/s) |
| (1) (2) (3) | 0,1 0,1 0,2 | 0,1 0,2 0,2 | 2,4 2,4 4,8 |
Rumus persamaan laju reaksi yang benar adalah ….
A. v = k [N2O4]2 [O2] D. v = k [N2O4] [O2]
B. v = k [ N2O4]2 [ O2]2 E. v = k [N2O4]
C. v = k [N2O4] [O2]2
14. Perhatikan reaksi kesetimbangan berikut!
N2O4(g) ⇋ 2NO2(g)
Jika diketahui harga K pada suhu 600°C adalah 1,8 x 104 dan pada suhu 1000°C adalah 2,8 x 104, pernyataan yang tepat mengenai reaksi kesetimbangan tersebut adalah ….
A. ΔH reaksi ke kanan berharga negatif
B. reaksi tersebut memiliki harga Kp = Kc
C. konsentrasi NO2 akan bertambah jika suhu dinaikan
D. jika tekanan diperbesar, konsentrasi N2O4 berkurang
E. konsentrasi N2O4 akan bertambah jika volume diperbesar
15. Perhatikan tabel penerapan zat, peranan dan sifat koloid berikut ini!
| No. | Zat | Peranan | Sifat Koloid |
| (1) (2) (3) (4) (5) | Serbuk karbon Tawas Norit Gelatin Cuka | Pemutihan gula tebu Penjernihan air Menghilangkan bau badan Campuran pada es krim Pengolahan getah karet | Elektroforesis Koagulasi Dialysis Koloid pelindung Adsorpsi |
Pasangan data yang ketiganya berhubungan secara tepat adalah ….
A. (1) dan (2) D. (3) dan (4)
B. (1) dan (3) E. (4) dan (5)
C. (2) dan (4)







